近日,我院药学系脑功能与疾病实验室/汕头大学医学院第一附属医院神经外科双聘教授纪晓宇团队在神经科学顶级期刊《Molecular Psychiatry》(中科院1区TOP,5年平均影响因子11.8)上发表了题为《Genome-wide consensus transcriptional signatures identify synaptic pruning linking Alzheimer’s disease and epilepsy》的研究论文。该研究通过整合基因组学、单细胞转录组学与计算神经科学,首次构建了一个从分子、细胞到神经环路的统一框架,系统揭示了阿尔茨海默病(AD)与癫痫(EP)共病的核心机制,为开发新的治疗策略提供了重要的理论依据。
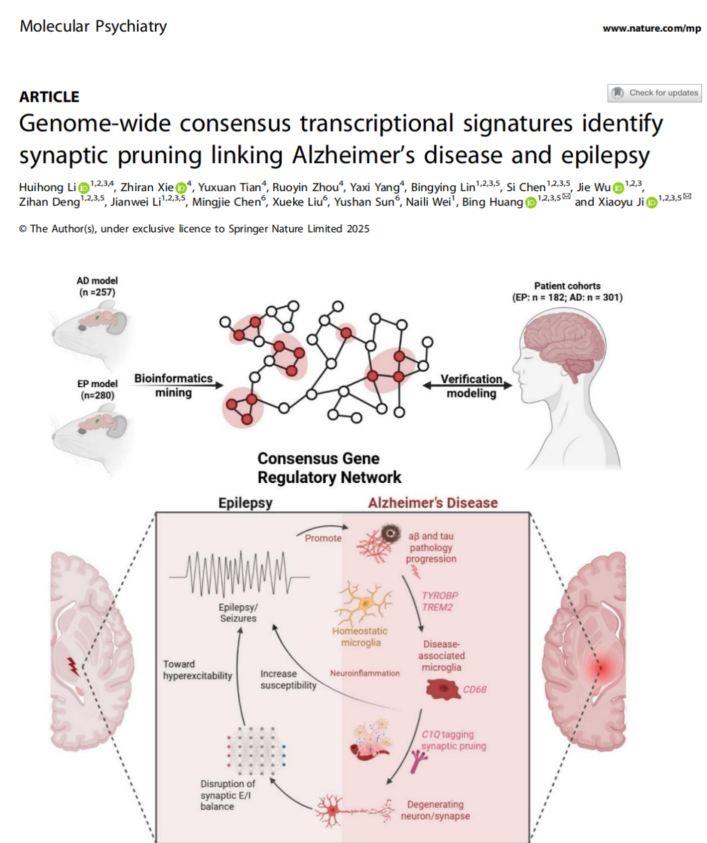
阿尔茨海默病与癫痫是两种常见且相互加剧的神经系统疾病,但其共病的深层机制一直是领域内未解之谜。为解决这一难题,本研究团队采取了跨物种、多模型、交叉学科的研究策略。在分子层面,团队整合了来自537例小鼠模型和483例人脑组织的转录组数据,通过基因共表达网络分析,发现了一个在AD与EP中高度保守的免疫相关基因模块。该模块的核心是一个由TYROBP、TREM2和C1Q等基因构成的枢纽网络,它们共同调控小胶质细胞介导的突触修剪——大脑免疫细胞对冗余突触的清除过程。在细胞层面,通过单细胞转录组分析,团队证实这些枢纽基因在AD和EP患者的特定小胶质细胞亚群中显著上调。这些亚群的功能特征正是补体激活与突触吞噬,从而在细胞层面将分子发现与病理过程直接关联。为回答“突触修剪如何导致癫痫样网络异常”这一关键问题,团队引入了计算神经科学方法,构建了脉冲神经网络模型进行仿真模拟。模型结果揭示了一个关键机制:抑制性突触的丢失对神经网络兴奋/抑制(E/I)平衡的破坏力,远大于兴奋性突触的丢失。这种“不对称效应”会直接导致神经网络同步化水平异常升高,从而解释了AD大脑中易于出现癫痫发作的环路基础。综上所述,该研究创新性地描绘了一条从分子(TYROBP-TREM2-C1Q)→细胞(小胶质细胞异常激活)→环路(E/I失衡、同步化增强)的完整致病通路,为理解AD与EP的共病提供了统一的理论模型。这项工作是交叉学科研究的典范,凸显了计算生物学与实验神经科学相结合在解析复杂脑疾病机制中的强大力量。该研究得到了国家自然科学基金、广东省科技计划等多个项目的支持。
汕头大学医学院实习生李晖泓(原广东以色列理工学院学生,目前在耶鲁大学就读硕士研究生)为第一作者,通讯作者为纪晓宇副教授、黄冰教授。该团队长期致力于神经系统疾病的电生理、分子机制及神经药理研究,尤其关注神经炎症和突触可塑性在疾病发生发展中的作用。
通知类别:汕医新闻 撰稿人:科研处 审核人:组织宣传统战部






 最新要闻
最新要闻